12月6-8日,欧洲肿瘤内科学会免疫肿瘤学(ESMO Immuno-Oncology)年夜会在瑞士日内瓦召开,齐鲁制药以壁报情势陈述了QLS31905在晚期实体瘤患者中的I期临床实验最新研究成果(壁报编号:132P)。首要研究者为北京年夜学肿瘤病院的沈琳传授。
QLS31905是由齐鲁制药自立研发的靶向Claudin18.2的双特异性T细胞跟尾器(Bispeific T cell Engager)。本研究的首要目标是摸索QLS31905在晚期实体瘤患者中平安性、耐受性,和初步的抗肿瘤活性。
研究布景和设计:
Claudin18.2是具有高度特异性的细胞概况份子,其异常激活表达常见在原发性胃癌和胰腺癌、食管癌等实体瘤[1],[2]。QLS31905与肿瘤细胞概况的Claudin18.2和T细胞概况的CD3连系,经由过程召募和激活肿瘤细胞四周的T细胞,对肿瘤细胞进行延续地杀伤裂解。本研究纳入尺度医治掉败或不合用或无尺度医治的晚期实体瘤患者。研究分为剂量递增和剂量拓展两个阶段。剂量递增阶段采取加快滴定和i3+3的研究设计,QLS31905单次给药剂量依照0.5μg/kg QW、1.5μg/kg QW、5μg/kg QW、15μg/kg QW、45μg/kg QW、100μg/kg QW、200μg/kg QW、350μg/kg QW、500 μg/kg Q2W递增,首要终点是剂量限制毒性(DLT)和最年夜耐受剂量(MTD),次要终点是平安性、药代动力学和药效动力学、免疫原性。剂量拓展阶段的首要终点是客不雅减缓率(ORR),次要终点是疾病节制率(DCR)、无进展保存期(PFS)、整体保存期(OS)。
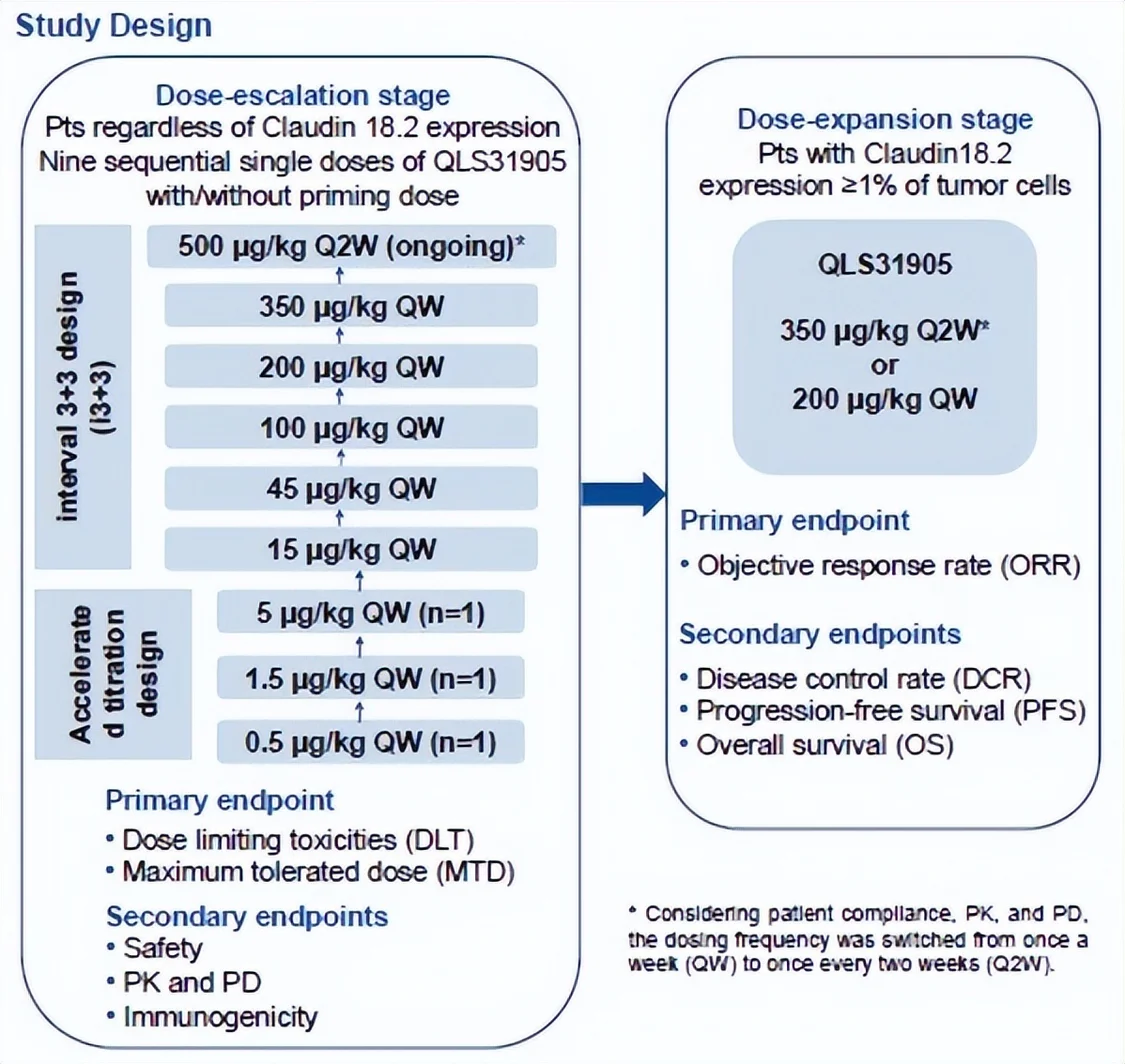
研究成果:
截止2023年7月17日,总计纳入52例受试者,包罗31例胃癌和12例胰腺癌患者。剂量递增阶段,总计22例受试者从0.5μg/kg QW爬坡到350 μg/kg QW队列,今朝500 μg/kg Q2W剂量程度正在进行中。剂量拓展阶段采取了200μg/kg QW和350μg/kg Q2W两个剂量程度,总计纳入30例受试者。
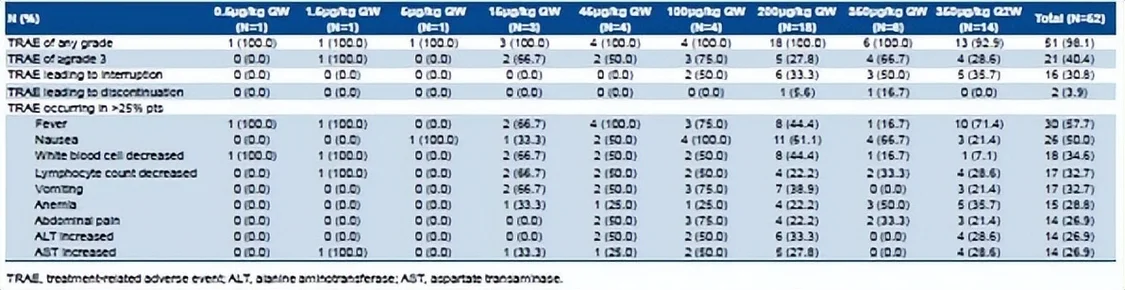
平安性方面,DLT未产生,还没有肯定MTD。总计21例(40.4%)受试者产生了≥3级的医治相干不良事务(TRAE)。10例(19.2%)受试者产生了医治相干的严重不良事务。2例受试者(3.8%)产生了致使住手医治的TRAE。最多见的TRAE是发烧(30例,57.7%)、恶心(26例,50.0%)、白细胞计数下降(18例,34.6%)。350 μg/kg QW队列中的2例患者产生3级和以上的细胞因子释放综合征。
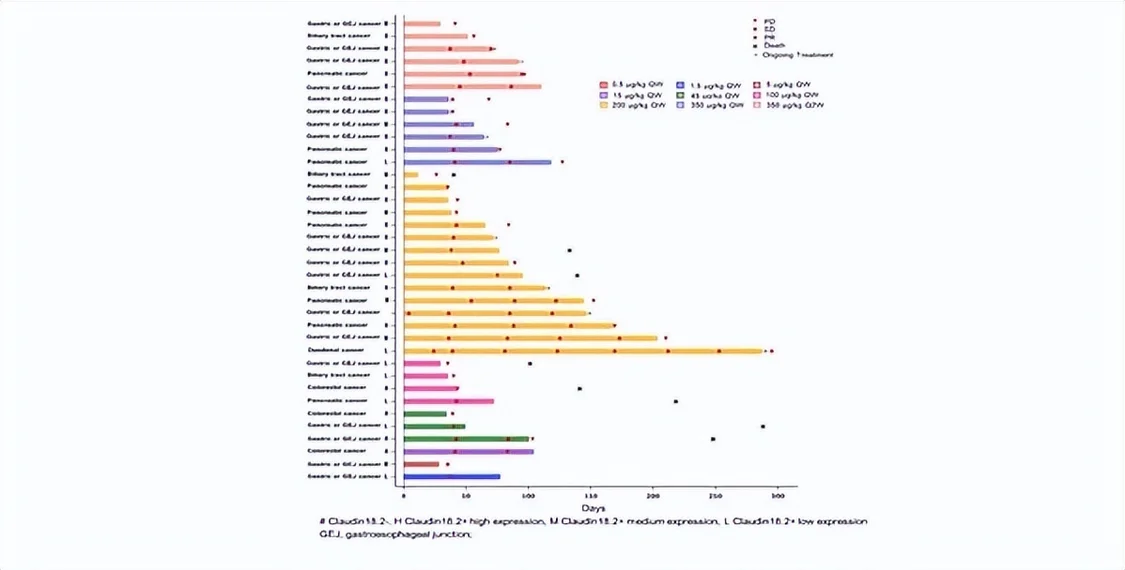
疗效方面,在疗效可评价的27例受试者中,ORR为11.1%,DCR为63.0%。到达部门减缓(PR)的3例患者中,2例为胰腺癌,1例为胆囊癌,Claudin18.2表达程度均为中/高表达。在14例疾病不变(SD)的患者中,8例靶病灶缩小,此中7例为Claudin18.2中/高表达。
综上,QLS31905在晚期实体瘤患者中揭示出杰出的平安性、耐受性、和初步的抗肿瘤活性。今朝QLS31905的II期临床实验正在进行中。
【参考文献】
1. Sahin U, et al. Clin Cancer Res. 2008;14(23):7624-34.
2. Singh P, et al. J Hematol Oncol. 2017;10(1):105.
责任编纂:赵硕